英文特生物技术(北京)有限公司品牌商
11 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 1
- 0
文献支持
IN-WB001 Invent ® RIPA裂解液
¥1060
推荐产品
公司新闻/正文
WB 样品制备干货
3754 人阅读发布时间:2019-09-02 09:38
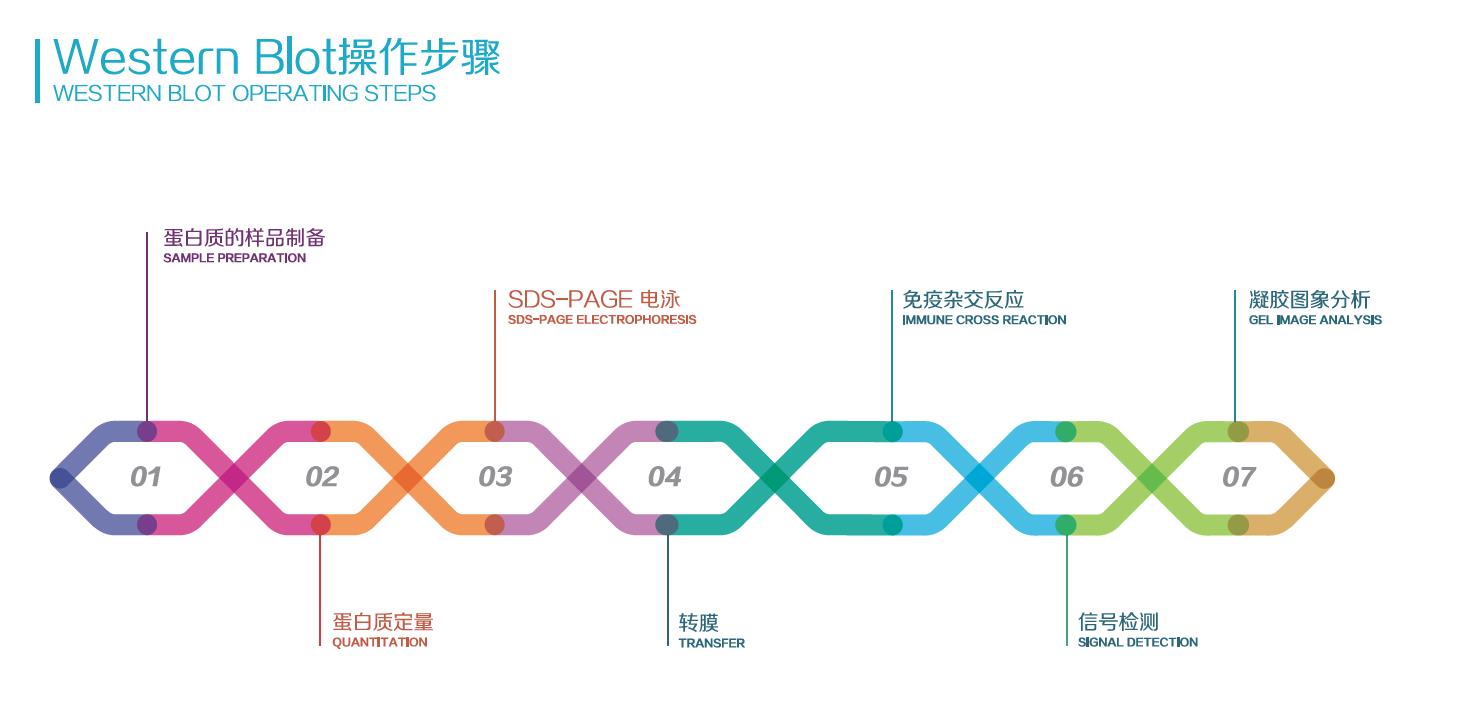
Western Blot 已经走入千家万室,成为实验室的看家实验。据悉有小伙伴 8 天能撸 12 次 WB,但是结果总是不尽人意。WB 能否十分成功,大概一分靠操作,一分靠试剂,一分靠运气,七分靠样品质量!
样品的质量直接决定了 WB 的结果,蛋白提取是 WB 成功的第一步,所以 WB 样品制备很重要!
为此 Invent 柱式法蛋白提取专家为大家总结了 WB 样品制备的方法及注意事项,请搬好小板凳仔细看!
样品制备前
1 资料查找
首先要确定自己的样品种类及数量,WB 为了要验证什么结论?目标蛋白的表达量如何?蛋白定位在哪里?目标蛋白是否有特殊的性质?通过这些内容来确定自己需要制备的是什么蛋白!
例如:
*研究小鼠肝脏组织,目标蛋白表达量很高,想证明这个已知蛋白的表达,那就进行组织样品总蛋白提取即可。(总蛋白如何提取点这里)
*研究 293 细胞,目标蛋白在胞质和胞核内均有表达,想验证目标蛋白在两个不同组分中表达量的对比,那就需要进行细胞样品的胞质胞核组分分离,分别用胞质和胞核蛋白组分检测。(胞质胞核如何分离点这里)
*研究 Hela 细胞,目标蛋白在内质网上,蛋白表达量较低,用总蛋白验证检测条带较弱,需要进行细胞样品内质网蛋白富集后再检测,提高检出效率。(细胞器如何分离点这里)
*研究小鼠心肌组织,进行蛋白定位或研究蛋白转运过程,那就需要进行细胞组分分离,分别检测细胞核,细胞浆,细胞器,细胞膜,内体等组分。(如何进行细胞组分分离点这里)
2 选择合适的提取方法
明确好自己需要制备什么蛋白后,选择相应的方法进行提取。选择方法的原则是保证提取的蛋白图谱正确完整,且比例正确的前提下,达成最大限度的提取!部分核蛋白,细胞器蛋白,膜蛋白属于不可溶性蛋白很难提取,以及难以处理的样品例如皮肤,骨骼,血管,肌腱,肠,肌肉,昆虫组织,建议大家使用专用试剂盒进行蛋白提取,不需要花时间摸索提取条件,即可得到满意结果。(特殊样品如何提取总蛋白点这里)
样品制备时
1 样品前处理
细胞样品在提取前需要使用 PBS 清洗两遍,以减少培养基对样品的干扰,悬浮细胞可 500Xg 低速离心后收集进行蛋白提取。贴壁细胞可在培养器皿中直接进行蛋白提取。蛋白提取前建议进行细胞计数(细胞计数方法点这里)以确定提取中添加裂解液的比例,得到最佳提取效率。
组织样品推荐的取样顺序:最先取消化系统相关的组织(如胃、大小肠、肝脏、胰腺等)和富含巨噬细胞的组织(如肺),然后取生殖相关的组织(如卵巢、子宫、睾丸等),最后取心、脾、肾、脑等器官。取下的组织如不马上使用,需冻存在液氮或-80 度冰箱里。组织样品在提取前也需要用 PBS 清洗,一些含血量丰富的组织,建议使用红细胞裂解液(Invent Cat# WA-007)去除红细胞,以避免血液中 IgG 对后续实验的影响。组织研磨大部分需要匀浆处理,传统的匀浆方式使用的力度和次数不同,均会影响提取结果,造成人为误差,致使 WB 结果重复性差。(PS:Invent 蛋白提取试剂盒无需匀浆仪,特殊的研磨方式,保证你的重复性,「手残」党也不用怕哈!)
2 关于降解
组织和细胞内常含有内源性蛋白酶,在提取蛋白的过程中,有可能消化目的蛋白,可从以下几个方面可避免蛋白被降解:
1. 加入蛋白酶抑制剂和磷酸酶抑制剂。(如何选择抑制剂及添加方法点这里)链接:
2. 加快提取速度,避免蛋白降解。
样品制备后
1 浓度检测与评估
蛋白提取完成后,建议用 BCA 法准确测定浓度(BCA 法测浓度操作详解点这里) 以确保上样量清楚可控。
2 制样及样品储存
浓度测定后,建议将样品浓度调整到同一浓度,与 loading buffer 混匀煮沸后,离心后等体积等质量上样。(上样前制样详细说明点这里)
如果一次提取的蛋白用不完,建议制样后分装成小管-80 度储存,下次实验前拿出小管再次煮样使用,避免反复冻融,当然储存时间越长蛋白质量会越差哦!(样品保存还有哪些注意事项点这里)
3 WB 内参
尽管采取了多种方法来保证蛋白提取无失误、浓度相近,但在后续 WB 时仍需检测内参对照,以确保实验的严谨。(WB 内参如何选择点这里)