英文特生物技术(北京)有限公司品牌商
11 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
推荐产品
公司新闻/正文
如何用WB鉴定膜蛋白提取是否成功?
6559 人阅读发布时间:2023-03-14 16:45
膜蛋白的表达量通常较低,具有高度疏水性,较难溶解于一般的裂解液中,所以许多科研者选择提取富集膜蛋白后进行下游实验,以降低检测难度。但提取膜蛋白后我们该如何用WB鉴定提取是否成功,提取效率如何呢?
 确认验证目的
确认验证目的
WB实验前,首先要思考验证目的是什么?根据验证目的设计实验方案。通常验证目的有:
1) 膜蛋白提取得率如何?
2) 提出的是否是膜蛋白?
3) 提出的膜蛋白是否有明显的富集?
4) 提出的膜蛋白纯度如何,是否有其他组分交叉污染?
5) 是否可以检出目标蛋白?
 验证方法
验证方法
根据上述验证目的,一一对应验证方法:
1) 得到的膜蛋白溶液,使用BCA法定量进行浓度测定,以确认蛋白得率。
2) 使用专用的膜蛋白内参(Marker)检测,可检出膜蛋白内参可初步确认提出的是膜蛋白。
3)是否有效富集需要使用总蛋白样品作为对照,与总蛋白样品相比,膜蛋白组分中膜蛋白内参是否有明显的富集。
4) 检测关注的其他组分内参验证纯度,如关注膜蛋白中是否含有胞核蛋白,可使用胞核内参同时检测,检测无条带即为与胞核组分无交叉污染。
5) 检测目标蛋白,验证是否可以成功检测,结果是否符合预期。
 对照设置及上样方法
对照设置及上样方法
对照在WB验证中起到重要作用,务必要设置,一般可使用样品总蛋白(Total)作为对照,推荐使用无蛋白丢失的Invent柱式法总蛋白提取工具(cat#SD-001/SN-002)提取总蛋白作为无偏差的基线进行对比。如对比药物处理等不同方法对蛋白的影响,同时设置处理前后的总蛋白作为对照组更为严谨。
样品可根据检测需求按照对照(总蛋白),膜蛋白,其他关注组分的顺序进行上样,上样时需要注意各组分应使用等质量的样品上样,推荐先将各组分样品调整成同样浓度,再等体积上样。
 推荐使用的膜内参及其他各组分内参
推荐使用的膜内参及其他各组分内参
细胞膜内参:
Na+/K+ ATPase(100KD):存在于细胞膜中,是对钠和钾两种离子能进行交换的主动运输的酶。1957年由J.C.Skou所发现。除猫、狗等的红细胞膜等少数例外,在动物细胞膜中都存在。可作为经典的细胞膜内参。
Pan-cadherin(135KD ,Tissue specific express):钙粘蛋白是钙依赖性细胞粘附蛋白。在连接细胞时,它们优先以亲同的方式与自己相互作用。属于单通道I型膜蛋白。但P-Cadherin 具有一定的组织表达特异性,主要表达于胎盘、间皮组织、上皮细胞等。
其他各组分内参参考:

图1:常用动物细胞各组分内参,红色为非特异性内参
 如何理解膜蛋白中检测出管家基因
如何理解膜蛋白中检测出管家基因
在膜蛋白中检测出管家基因(Actin, GAPDH,Tubulin)一定是膜蛋白分离的不干净,有交叉污染吗?一直以来我们认为这些管家基因应该只在胞浆中表达,细胞膜中不应该含有这些成分,然而并非如此,有越来越多的研究表明【1,2,3】,这些管家基因也可能存在于质膜中或细胞表面。
如图2案例:分离后验证膜蛋白纯度时,检测膜内参Na+/K+ ATPase的同时检测Actin和Tubulin两种内参,可见Tubulin未在细胞膜组分中检出,而Actin则存在于细胞膜表面。所以使用一种管家基因验证膜蛋白纯度的时,检测到弱信号不足为奇,不能说明一定有交叉污染,可更换其它内参进行检测。

图2:Nutrients 2019, 11, 1473; doi:10.3390/nu11071473
 膜蛋白验证案例分享
膜蛋白验证案例分享
案例一:
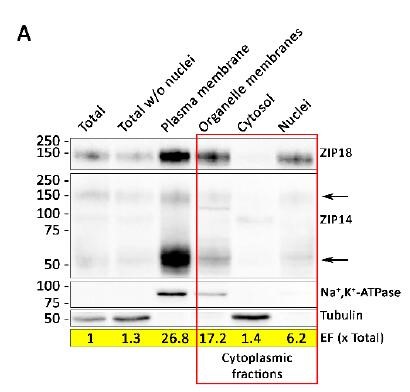
图3:Nutrients 2019, 11, 1473; doi:10.3390/nu11071473
Scheiber, I. F.等人【4】研究A549细胞中ZIP8和ZIP14的细胞定位,首先使用Invent柱式法质膜及组分分离试剂盒(Cat#SM-005)将细胞分为质膜(Plasma membrane),细胞器(Organelle membranes),细胞浆(cytosol),细胞核(nuclei)组分,将各组分等质量上样,并用总蛋白(Total 样孔1)作为对照,使用Tubulin作为胞浆及总蛋白内参,Na+/K+-ATPase作为质膜内参进行检测。结果可见,与总蛋白对比,细胞质膜组分(样孔3)中Na+/K+-ATPase明显富集,而无Tubulin检出,说明细胞质膜被成功富集,且与胞浆组分无交叉污染。此时如需验证与其他关注组分间交叉污染,还可使用其他组分的Marker(详见上图1参考)进行验证。检测分离效果后,验证目标蛋白ZIP8在细胞质膜,细胞器和细胞核组分中定位,而ZIP14则主要定位于细胞膜上的结论更具严谨性。
案例二:
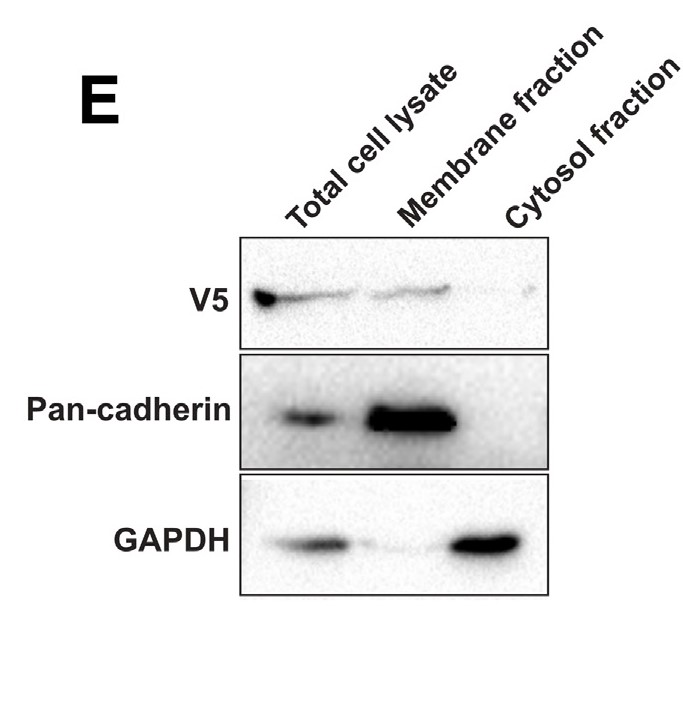
图4:https://doi.org/10.1016/j.jcmgh.2022.01.017
Cheng, Y等人【5】证实V5-FACI的亚细胞定位时,用Invent柱式法质膜及组分分离试剂盒(Cat#SM-005)将AML 12-V5-FACI细胞进行细胞组分分离,分为总膜(质膜和细胞器膜)和胞浆组分。分离后将各组分等质量上样,总蛋白(Total)为对照,使用Pan-cadherin作为膜蛋白内参,GAPDH作为胞浆及总蛋白内参,经过检测,与总蛋白相比,在总膜组分中Pan-cadherin明显富集,同时无GAPDH检出,证实总膜被有效分离无污染。结果证明V5-FACI只在总膜(质膜和细胞器膜)组分中定位,但不在胞质组分中。
 小结
小结
如果使用Western blotting检测质膜富集效果,需要同时检测具有相同蛋白上样量的总蛋白作为阳性对照。我们推荐使用Minute TM Total Protein Extraction Kit (Cat# SD-001/SN-002)进行总蛋白提取,进行无偏差检测。用Na+/K+ ATPase作为质膜内参,并同时检测其他关注组分内参验证交叉污染问题。
 相关产品推荐
相关产品推荐
 SD-001/SN-002 Minute™ 动物细胞/组织总蛋白提取试剂盒 SM-005 Minute ™质膜蛋白和细胞组分分离试剂盒
SD-001/SN-002 Minute™ 动物细胞/组织总蛋白提取试剂盒 SM-005 Minute ™质膜蛋白和细胞组分分离试剂盒
 参考文献
参考文献
【1】Gruenstein E., et al. (1975). Actin associated with membranes from 3T3 mouse fibroblast and Hela cells. Journal of cell Biology. 64:223-234. 【2】Terrasse R., et al. (2012). Human and pneumococcal cell surface glyceraldehydes -3-phosphate dehydrogenase (GAPDH) proteins are both ligands of human C1q protein. J. Biol. Chem. 287:42620-42633. 【3】Wolff J. (2009). Plasma membrane tubulin. Biochemica et BiophysicaActa. (BBA)-Biomembranes 1788:1415-1433. 【4】Scheiber, I. F., Alarcon, N. O., & Zhao, N. (2019). Manganese Uptake by A549 Cells is Mediated by Both ZIP8 and ZIP14. Nutrients, 11(7), 1473. 【5】Cheng, Y., Kang, X. Z., Cheng, T., Ye, Z. W., Tipoe, G. L., Yu, C. H., ... & Jin, D. Y. (2022). FACI Is a Novel CREB-H–Induced Protein That Inhibits Intestinal Lipid Absorption and Reverses Diet-Induced Obesity. Cellular and Molecular Gastroenterology and Hepatology.