英文特生物技术(北京)有限公司品牌商
11 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
推荐产品
公司新闻/正文
一文读懂线粒体自噬!
7032 人阅读发布时间:2025-10-24 13:56
线粒体自噬(Mitophagy)是一个非常重要且有趣的细胞生物学过程。是细胞通过“自噬”的机制,选择性地清除掉受损或功能失常的线粒体。我们可以把它想象成细胞的“内部质量管理体系”。当工厂(细胞)里的某个机器(线粒体)老化、损坏或不再需要时,质检员会给它贴上“报废”标签,然后回收车会将其运往回收中心(溶酶体)进行拆解和再利用。
线粒体是细胞的“能量工厂”,负责产生能量(ATP),同时还参与调节细胞代谢、钙稳态和细胞凋亡等关键过程。然而,线粒体在能量生产过程中也会产生副产品——活性氧(ROS),这些物质会损伤线粒体自身的DNA和蛋白质。
如果一个受损的线粒体不被及时清除,会带来一系列问题:
-
能量生产下降:效率低下,影响细胞功能。
-
ROS大量产生:受损线粒体会泄漏更多ROS,进一步氧化损伤细胞内的其他成分,如蛋白质、脂质和DNA,加速细胞衰老。
-
诱发细胞凋亡:严重的线粒体损伤会释放促凋亡因子,导致细胞程序性死亡。
-
与疾病相关:线粒体自噬功能障碍与多种神经退行性疾病(如帕金森病、阿尔茨海默病)、代谢性疾病、心血管疾病、癌症乃至衰老过程本身都密切相关。
因此,及时清除受损线粒体,对于维持细胞健康、能量稳态和整体生存至关重要。
线粒体自噬的核心是“标记”受损线粒体,并将其“运送”到溶酶体进行降解。主要有泛素依赖型和受体依赖型两条经典通路:
a) PINK1-Parkin 通路(泛素依赖型,研究最深入的通路)
这条通路是清除严重受损线粒体的主要方式,与帕金森病密切相关。
-
线粒体受损:当线粒体膜电位(ΔΨm)下降时(这是功能失常的关键标志),其膜上的通道会关闭。
-
PINK1 稳定:在健康线粒体上,PINK1蛋白会被快速剪切并降解。但在受损线粒体上,由于膜电位丧失,PINK1得以稳定并积累在线粒体外膜上。
-
招募 Parkin:积累的PINK1会磷酸化(激活)泛素(Ubiquitin)和E3泛素连接酶Parkin,并将其从细胞质招募到受损线粒体上。
-
泛素化标记:被激活的Parkin会给受损线粒体外膜上的大量蛋白质“贴上”泛素标签(泛素化)。这些泛素链就像一个个“吃掉我”的信号旗。
-
自噬体包裹:细胞质中的自噬受体蛋白(如OPTN, NDP52)能同时识别这些泛素标签和自噬体膜上的LC3蛋白,从而像桥梁一样将受损的线粒体拉进正在形成的自噬体(Autophagosome)中。
-
降解与回收:自噬体与溶酶体(Lysosome)融合形成自噬溶酶体(Autolysosome),其中的酸性水解酶将线粒体降解,分解成的氨基酸、脂肪酸等基本元件被细胞回收利用。
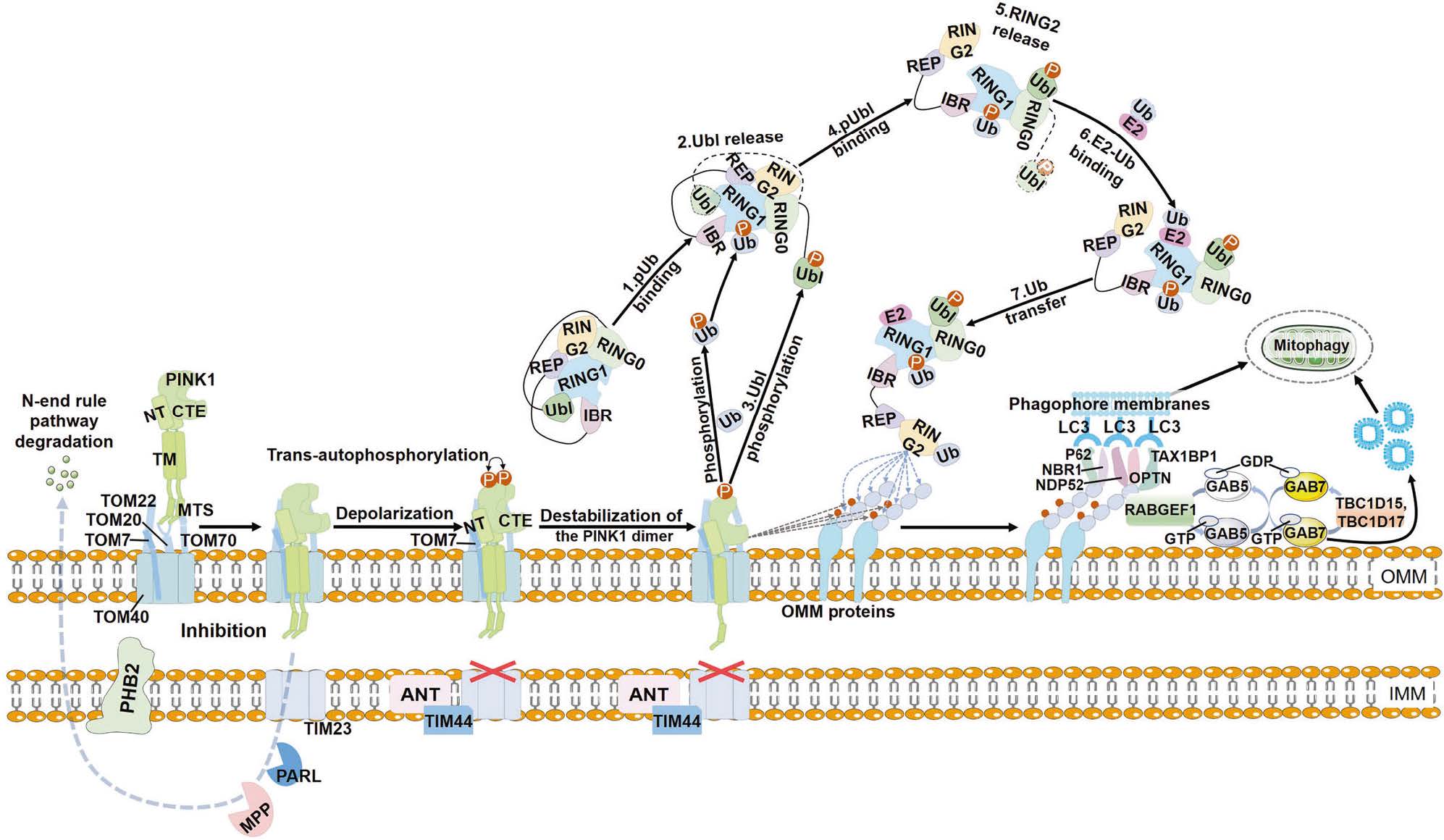
图1.PINK1-Parkin‐mediated mitophagy
图片来源:10.1038/s41392-023-01503-7
b) 受体介导的通路(不依赖Parkin)
一些线粒体外膜蛋白本身就可以作为自噬受体,直接与LC3结合,介导线粒体自噬。这些受体通常会在特定应激条件下被激活。最重要的两个是:
-
BNIP3 和 NIX:这些受体在缺氧条件下被 HIF-1α 转录上调,主要在红细胞成熟、缺氧(低氧)等过程中被诱导表达,用于清除线粒体。
-
FUNDC1:主要感知低氧压力,其活性受磷酸化调控,去磷酸化后能更好地与LC3结合,启动线粒体自噬。
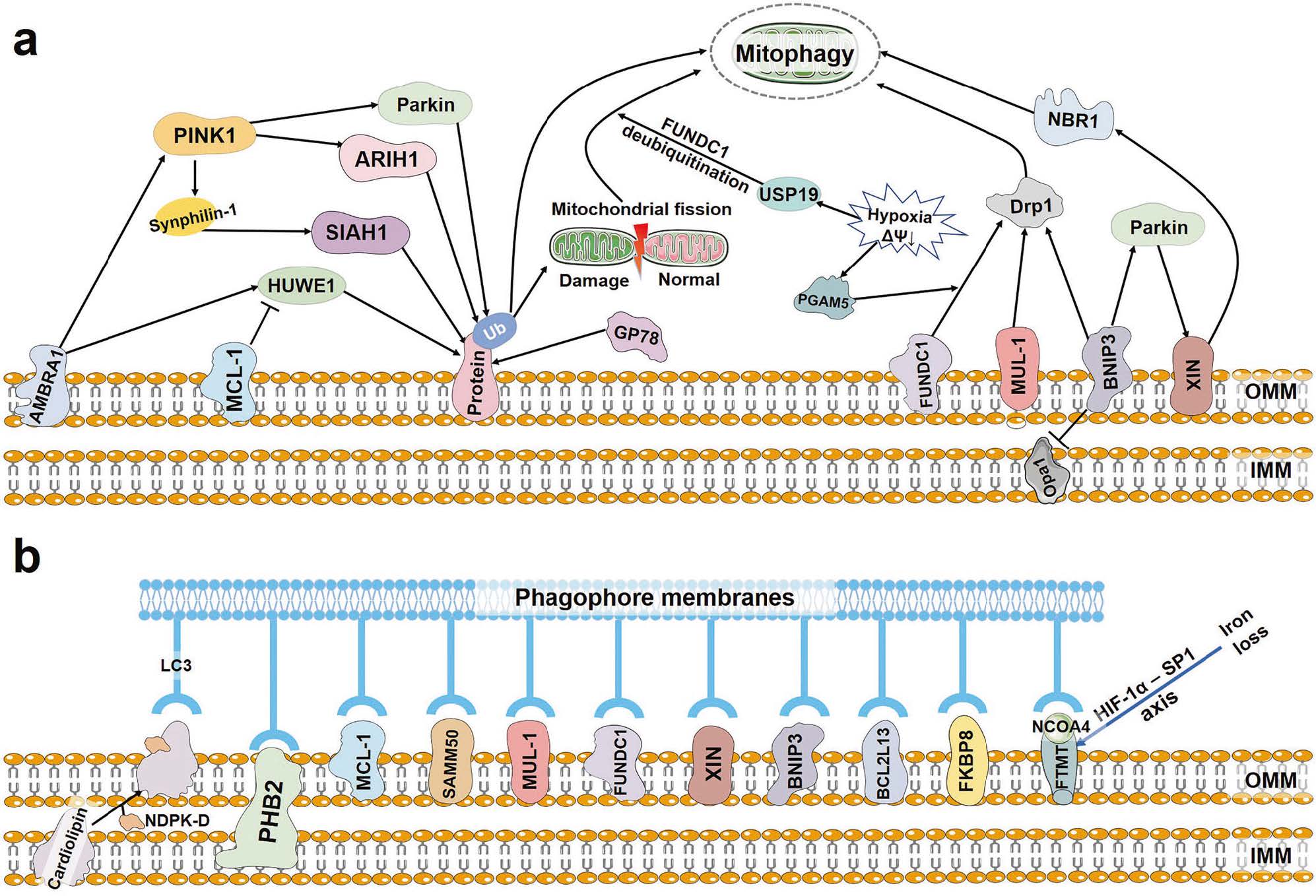
图2.PINK1-Parkin-independent mitophagy.
图片来源:10.1038/s41392-023-01503-7
其他调控通路
-
AMPK 通路:能量缺乏时激活 AMPK,促进线粒体自噬。
-
mTOR 通路:营养充足时抑制自噬,抑制 mTOR(如雷帕霉素处理)可诱导线粒体自噬。
-
SIRT1/PGC-1α 通路:通过去乙酰化调控线粒体生物发生与自噬的平衡。
-
cGAS-STING 通路:线粒体损伤释放 mtDNA,激活 cGAS-STING,诱导炎症反应,间接影响线粒体自噬。
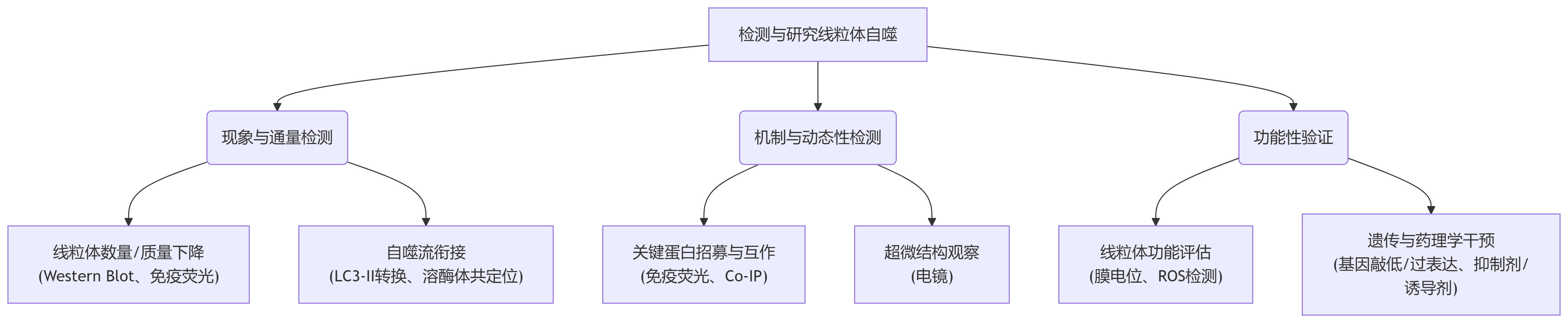
图3.线粒体自噬研究方案总览
一、 现象与通量检测
1. Western Blot(蛋白质免疫印迹)
-
检测指标:
线粒体蛋白的降解: 检测线粒体标志蛋白(如TOM20, TIM23, COX IV)的丰度。发生有效的线粒体自噬时,这些蛋白的含量会显著下降。
自噬体标记蛋白的转换: 检测LC3。LC3-I(胞质形式)会脂化为LC3-II(自噬体膜形式)。LC3-II的含量与自噬体的数量成正比。线粒体自噬发生时,LC3-II水平通常会升高。
关键蛋白的活化: 检测PINK1的稳定和积累(分子量约63kDa),以及Parkin向线粒体的招募(可通过线粒体组分分离后检测Parkin含量)。
2. 免疫荧光(Immunofluorescence, IF)与共聚焦显微镜
-
检测指标:
线粒体(Mitochondria):抗TOM20, ATP5A, 或使用染料如MitoTracker。
自噬体(Autophagosome): 抗LC3抗体。
如果观察到线粒体结构与LC3斑点(puncta)清晰地共定位(黄色斑点),这就是线粒体被自噬体吞噬的直接视觉证据。
二、 机制与动态性检测
3. 线粒体自噬特异性报告系统 —— mt-Keima
-
原理:Keima是一种对pH值敏感的荧光蛋白,其激发光谱会随pH变化而改变,在中性环境下(pH 7.4),短波长激发光(440 nm)占主导,呈现绿色荧光;在酸性环境下(pH 5.0以下),长波长激发光(586 nm)占主导,呈现红色荧光。
在线粒体的生理pH值(pH 8.0),主要激发波长较短。在线粒体自噬后,mt-Keima进入酸性溶酶体(pH 4.5),会逐渐转变为较长波长的激发光,形成明显的荧光比率变化。从而实现线粒体自噬过程可视化。
4. 免疫共沉淀(Co-Immunoprecipitation, Co-IP)
-
应用示例: 验证Parkin是否介导了泛素化。用抗泛素(Ub)抗体下拉蛋白复合物,然后用抗线粒体蛋白(如TOM20)的抗体进行检测,如果泛素化水平升高,说明线粒体被泛素标记。同样,可以验证自噬受体(如OPTN)是否与泛素链和LC3结合。
5. 电子显微镜(Electron Microscopy)
-
识别特征:寻找被双层或多层膜结构包裹的、内部具有线粒体嵴结构的细胞器。这些就是包裹了线粒体的自噬体(mito-autophagosomes)或自噬溶酶体(mito-autolysosomes)。
三、 功能性验证
6. 线粒体功能检测
-
线粒体膜电位(ΔΨm):使用染料如JC-1或TMRE。健康的线粒体膜电位高,染料会聚集(JC-1形成红色聚集体;TMRE荧光强)。发生线粒体自噬时,通常会先清除膜电位丧失的线粒体,因此整体群体的平均膜电位可能会升高。
-
活性氧(ROS)水平:使用染料如MitoSOX(检测线粒体超氧化物)。成功的线粒体自噬清除了受损线粒体,应导致细胞总ROS水平下降。
7. 遗传与药理学干预
-
基因敲低/敲除(KD/KO):利用siRNA, shRNA或CRISPR-Cas9技术敲低/敲除线粒体自噬关键基因(如PINK1, Parkin, OPTN, NDP52, FUNDC1等),然后观察上述检测指标(如线粒体清除、LC3共定位)是否被阻断。
-
基因过表达(OE):过表达Parkin或FUNDC1等,看是否能诱导线粒体自噬。
-
诱导剂和抑制剂:
诱导剂: CCCP/FCCP(线粒体解偶联剂,强烈诱导线粒体膜电位丧失,从而激活PINK1-Parkin通路);缺氧(激活FUNDC1通路)。
抑制剂:Bafilomycin A1(抑制溶酶体V-ATPase,阻断自噬流末端降解);3-MA(抑制自噬体形成)。
《Activation of mitophagy improves cognitive dysfunction in diabetic mice with recurrent non-severe hypoglycemia》一文中,探讨了在糖尿病背景下,反复低血糖是否影响星形胶质细胞的线粒体自噬导致认知障碍,并验证激活线粒体自噬是否具有保护作用。
实验方法:
认知功能检测:Morris水迷宫(MWM)测试。
线粒体功能检测:膜电位(JC-1)、ROS(MitoSOX)、呼吸功能(Seahorse)、ATP含量、COX IV活性等。
线粒体自噬检测:WB检测PINK1、Parkin、LC3II、Beclin-1等;
免疫荧光共定位检测(LC3与TOM20);电镜观察自噬体。
细胞活力与凋亡:CCK-8、Hoechst染色、Annexin V检测。
实验结果:
1. RH抑制海马和星形胶质细胞的线粒体自噬:
DH组(糖尿病+RH)小鼠海马中LC3II、Beclin-1、PINK1表达下降,LC3与TOM20共定位减少。
HR组(高葡萄糖+反复低葡萄糖)星形胶质细胞中PINK1 mRNA和蛋白表达显著下降,自噬相关蛋白也降低。
2. 激活线粒体自噬改善线粒体功能:
-
使用雷帕霉素(RAPA)或过表达PINK1可: -
提高线粒体膜电位; -
降低ROS水平; -
增强呼吸功能(OCR、ATP产量); -
改善线粒体形态; -
减少细胞凋亡,提高细胞活力。
-
3. 激活线粒体自噬改善认知功能:
-
DH+RAPA组小鼠在MWM测试中表现更好(逃避潜伏期缩短,穿越平台次数增加)。
-
海马线粒体功能(COX IV活性、ATP、SOD、MDA)也得到改善。
4. 抑制线粒体自噬(3-MA)则加重损伤。
机制示意图
高葡萄糖 + 反复低葡萄糖
↓
PINK1表达下降 → 线粒体自噬启动障碍
↓
自噬体形成减少 → 受损线粒体积累
↓
线粒体功能障碍 → 星形胶质细胞功能受损
↓
神经元支持能力下降 → 认知障碍
文章结论:
还在为繁琐的线粒体提取烦恼吗?Invent线粒体分离试剂盒,利用创新的离心管柱技术,配合温和高效的缓冲液,无需超速离心,1小时即可从细胞或组织中分离出完整性高、活性优异的线粒体,纯度与稳定性双双达标。
无论是代谢研究、细胞凋亡探索,还是疾病机制解析,Invent线粒体分离试剂盒均能提供可靠的一站式解决方案。操作简捷,省时省力,大幅提升实验可重复性,让您更专注于科学发现本身。(点击下方链接了解详情)
参考文献:
1.Zhao, L., Liu, D., Ma, W., Gu, H., Wei, X., Luo, W., & Yuan, Z. (2021). Bhlhe40/Sirt1 Axis-Regulated Mitophagy Is Implicated in All-Trans Retinoic Acid-Induced Spina Bifida Aperta. Frontiers in Cell and Developmental Biology, 9, 1025
2..Li, X., Hou, P., Ma, W., Wang, X., Wang, H., Yu, Z., ... & He, H. (2021). SARS-CoV-2 ORF10 suppresses the antiviral innate immune response by degrading MAVS through mitophagy. Cellular & Molecular Immunology, 1-12.
3.Dou, Y., & Tan, Y. (2023). Presequence protease reverses mitochondria‐specific amyloid‐β‐induced mitophagy to protect mitochondria. The FASEB Journal, 37(5), e22890.
4.Yi Wang, Li-Fan Hu, Na-Hui Liu, Jing-Song Yang, Lei Xing, Jee-Heon Jeong, Ling Li, and Hu-Lin Jiang.(2024).Mitophagy-Enhanced Nanoparticle-Engineered Mitochondria Restore Homeostasis of Mitochondrial Pool for Alleviating Pulmonary Fibrosis.ACS Nano.DOI: 10.1021/acsnano.4c10328
5.Xinnan Zhao; Xiaohan Yang; Cong Du; Hao Huimin; Lei Zhu; et al.(2024).Up-regulated succinylation modifications induce a senescence phenotype in microglia by altering mitochondrial energy metabolism.Journal of Neuroinflammation.DOI 10.1186/s12974-024-03284-4
6.Shouliang Wang; Haijiao Long; Lianjie Hou; Feng Bao-rong; Zihong Ma; et al.(2025).The mitophagy pathway and its implications in human diseases.Signal Transduction and Targeted Therapy. DOI 10.1038/s41392-023-01503-7
7.Wu, K., Huang, C., Zheng, W., Wu, Y., Huang, Q., Lin, M., ... & Liu, L. (2023). Activation of mitophagy improves cognitive dysfunction in diabetic mice with recurrent non-severe hypoglycemia. Molecular and Cellular Endocrinology, 112109.